Pensamos que el hecho de que los investigadores científicos formen a los estudiantes es una manera de avanzar ya que al aprender de una persona que se dedica a la ciencia por completo puede suponer que se atraiga más a los alumnos, proponiéndoles nuevas experiencias y proyectos y dándoles diferentes enfoques sobre lo que están estudiando.
RUTHERFORD; FÍSICA Y QUÍMICA
La Química y la Física son ramas de la ciencia que estudian la materia, pero son muy diferentes, ya que la física se basa en el estudio de la materia y la energía y la química se basa en el estudio de la materia y sus transformaciones. En un proceso físico, las sustancias siguen manteniendo su naturaleza y sus propiedades esenciales, es decir, sigue siendo la misma sustancia. En cambio, en un proceso químico se cambia la composición de la sustancia: una sustancia se transforma en otra, que puede tener propiedades similares o completamente distintas.
Rutherford dijo: ‘’Toda ciencia, o es Física, o es coleccionismo de sellos’’. Con esta frase, Rutherford, pretende decir que la Física es la más importante de las ciencias, la base de todo. Se considera que la Física engloba a muchas otras ramas de la ciencia por lo que, según Rutherford, todo lo que no se pueda demostrar a través de la Física se puede considerar ‘’coleccionar sellos’’, es decir, una actividad inútil y sin importancia. Esto es muy irónico, ya que más tarde ganó el Premio Nobel de Química a pesar de ser un físico, a lo que dijo: ‘’He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfosis de físico a químico’’. Con esta frase no solo se queja de que le dieran el premio de Química y no el de Física, sino que también remarca el hecho que también dijo con la frase anterior: la Física es la más importante de las ciencias y no puede compararse con ninguna otra.
El verdadero hecho por el que ganó el premio de Química fue porque la academia debía entregar premios a varios trabajos que habían destacado ese año, y consideraron que el trabajo del ganador del premio de Física se acercaba más a esta ciencia que el trabajo de Rutherford (del cual hablaremos más tarde), y que este pertenecía más al campo de la Química.
NIKOLA TESLA:
Nikola Tesla (1856-1943) fue un importante inventor, ingeniero mecánico, ingeniero eléctrico y físico. Tesla nació en Serbia, pero más tarde obtuvo la nacionalidad estadounidense.
Estudió en las universidades de Graz, en Austria, y Praga y trabajó en varias industrias eléctricas en Budapest y París, hasta que se mudó a Estados Unidos. Allí trabajó bajo las órdenes de Thomas Alba Edison y debido a sus continuas disputas dejó de trabajar con él y se asoció con G. Westinghouse, que compró las patentes de su motor y de un transformador a través del cual se facilitaba la distribución de corriente. Ganaron la batalla de la distribución de energía y Tesla ganó mucha fama en Estados Unidos.
Fundó en Nueva York un laboratorio de investigaciones electrotécnicas, donde descubrió el principio del campo magnético rotatorio y los sistemas polifásicos de corriente alterna. Creó el primer motor eléctrico de inducción de corriente alterna y en su honor se denomina tesla a la unidad de medida de la intensidad del flujo magnético en el sistema internacional.
Sus invenciones y patentes se sucedieron con rapidez, y en 1887 inventó el motor de inducción de corriente trifásica. En el motor, las tres fases actúan sobre el inducido de forma que se logra que éste gire al generarse un campo magnético rotatorio. Este invento se consiguió mejorar unos años más tarde ya que el rotor se movía con un poco de retraso con respecto a la frecuencia de corriente.
En 1891 inventó la bobina que lleva su nombre. Ésta consiste en un transformador con un núcleo de aire y con una espiral primaria y otra secundaria en resonancia paralela. Con la bobina fue capaz de crear un campo de alta tensión y alta frecuencia. Un par de años más tarde descubrió la llamada ‘’luz de Tesla’’, un fenómeno de carácter ondulatorio en las corrientes alternas de alta tensión y alta frecuencia.
Se dice que fue un personaje muy excéntrico y que no prestaba atención a sus finanzas, por lo que murió empobrecido a los 86 años.
Como ya hemos mencionado antes, tuvo una gran disputa con Thomas A. Edison y Tesla, empeñado en demostrar la superioridad de su corriente alterna frente a la corriente continua de Edison, empezó la llamada ‘’batalla de las corrientes’’ (ganada por Tesla). Más tarde apareció Marconi, que ganó el Premio Nobel por su aparato de radio, aparato que contaba con numerosas aportaciones tecnológicas de Tesla, por lo que entraron en conflicto.
EN EL CAPÍTULO DE RUTHERFORD...:
En el capítulo de Rutherford se indican el descubrimiento de varios fenómenos físicos que fueron muy importantes con respecto al desarrollo de la sociedad del siglo XX y que siguen siendo de gran importancia.
La fluorescencia y la fosforescencia se obtienen a partir de dos clases distintas de minerales luminiscentes, los cuales eran fenómenos naturales llamados “luminiscencias” y conocidos desde hacía bastante tiempo por los geólogos, físicos y químicos. Los fluorescentes emitían una extraña luz azulada al ser estimulados por radiación externa, mientras que los fosforescentes emitían una luz verdosa la cual persistía aun cuando se les dejaba de iluminar.
Los rayos x son radiaciones electromagnéticas cuya gran virtud es la penetrabilidad en ciertas sustancias como la piel, los tejidos, las hojas de aluminio, o el papel. Además de esto, también son capaces de hacer fotografías las cuales suelen ser utilizadas para fines médicos. El descubrimiento de estos rayos tuvo lugar hacia el año 1895, cuando el físico alemán Wilhelm Conrad Röntgen experimentaba con los tubos de Hittorff-Crookes y la bobina de Ruhmkorff, para investigar la fluorescencia violeta que producían los rayos catódicos.
Tras cubrir el tubo con un cartón negro para eliminar la luz visible, observó un débil resplandor amarillo-verdoso proveniente de una pantalla con una capa de platino-cianuro de bario, que desaparecía al apagar el tubo. Determinó que los rayos creaban una radiación muy penetrante, pero invisible, que atravesaba grandes espesores de papel e incluso metales poco densos. Usó placas fotográficas para demostrar que los objetos eran más o menos transparentes a los rayos X dependiendo de su espesor y realizó la primera radiografía humana, usando la mano de su mujer. Los llamó "rayos incógnita", o "rayos X" porque no sabía qué eran, solo que eran generados por los rayos catódicos al chocar contra ciertos materiales.
Otro de los grandes descubrimientos fue la radiactividad, la cual consistía en la desintegración espontánea de ciertos átomos pesados. Esta descomposición atómica se basaba en tres tipos de emisiones:
alfa→ átomos de hierro
beta→ electrones
gamma→ radiación electromagnética muy energética (de altísima frecuencia) y, en consecuencia, cortísima longitud de onda
En el libro también se menciona que Joliot y Marie Curie demostraron que muchas sustancias emitían rayos que solo podían provenir de sus átomos. A este fenómeno lo llamaron radiactividad. Además de los Curie, la familia de Becquerel llevaba varias generaciones experimentando con sustancias fosforescentes,y después del descubrimiento de los rayos x, se dedicó a impresionar varios objetos metálicos en placas fotográficas con sales de uranio con el objetivo de averiguar la capacidad de penetrabilidad que tenían los rayos fosforescentes. Becquerel cubría una placa fotográfica con papel negro de manera que no la impresionara la luz del sol. Sobre ella colocaba un objeto metálico, como una moneda, lo cubría todo con sal de uranio y lo exponía al Sol. La luz del Sol excitaba la fosforescencia de la sal. Entonces Becquerel revelaba la placa y la imagen era debida sólo a la luz fosforescente. Aunque muchos libros dicen que Becquerel descubrió la radioactividad por casualidad, la verdad es que no fue así. Después de observar cómo la imagen de la moneda que había interpuesto entre la placa y las sales uranio salía nítida a pesar de que el día era nublado, hizo varias repeticiones del experimento, llegando a la conclusión de que las sales emitían rayos que no tenían nada que ver con la fosforescencia, y que era sólo el uranio el que emitía algún tipo de radiación nueva.
Finalmente, los Curie y Rutherford consiguieron aclarar qué era la radiactividad, lo cual fue muy importante para Becquerel ya que gracias a esto, se percató de la importancia de su descubrimiento. Después de esto, Rutherford siguió estudiando la conductividad eléctrica de los gases y descubrió que los elementos radiactivos emitían dos clases de rayos muy distintas a las cuales llamó alfa y beta.
Las radiaciones alfa, beta y gamma, son tipos de reactivos los cuales tienen unas características concretas.
Radiación alfa: es un tipo de radiación poco penetrante que puede ser detenida por una simple hoja de papel. Rutherford sugirió que los rayos alfa son iones de átomos de Helio moviéndose rápidamente. Este tipo de radiación la emiten núcleos de elementos pesados situados al final de la tabla periódica. Estos núcleos tienen muchos protones y la repulsión eléctrica es muy fuerte, por lo que tienden a obtener N aproximadamente igual a Z, y para ello emite una partícula alfa. En el proceso se desprende mucha energía que se convierte en la energía cinética de la partícula alfa, es decir que estas partículas salen con velocidades muy altas. En el proceso un núcleo cualquiera de número másico A y número atómico Z, se convierte en otro núcleo Y con número másico A-4 y nºatómico Z-2, y se emite una partícula alfa.
Radiación beta: su poder de penetración es mayor que las alfa. Son frenadas por metros de aire, una lámina de aluminio o unos cm de agua. Existen tres tipos de radiación beta: radiación beta menos, radiación beta más y captura electrónica.
radiación beta - : aparece para cualquier tipo de núcleo, pero es típica de núcleos con exceso de neutrones. Es un mecanismo usado por los núcleos para llegar a la línea de estabilidad. La radiación Beta - consiste en la emisión espontánea de electrones por parte de los núcleos.
radiación beta + : mediante este mecanismo un núcleo emite espontáneamente positrones, e+, antipartículas del electrón de igual masa pero con carga eléctrica opuesta. Lo que ocurre es que un protón del núcleo se desintegra dando lugar a un neutrón, un positrón o partícula Beta + y un neutrino . Así el núcleo se desprende de los protones que le sobran y se acercan a la línea de estabilidad N = Z. Por ello se da en núcleos con exceso de protones.
captura electrónica: se da en núcleos con exceso de protones. El núcleo captura un electrón de la corteza electrónica, que se unirá a un protón del núcleo para dar un neutrón.
Radiación gamma: en este tipo de radiación el núcleo no pierde su identidad. Mediante esta radiación el núcleo se desprende de la energía que le sobra para pasar a otro estado de energía más baja. Emite rayos gamma, o sea fotones muy energéticos. Este tipo de emisión acompaña a las radiaciones alfa y beta. Es una radiación muy penetrante, atraviesa el cuerpo humano y sólo se frena con planchas de plomo y muros gruesos de hormigón. Al ser tan penetrante y tan energética, de los tres tipos de radiación es la más peligrosa.
La ley de desintegración atómica dice que: el ritmo con que una sustancia radiactiva emite partículas radiactivas disminuye exponencialmente con el tiempo. La desintegración de un núcleo cualquiera se produce al azar, y el número de núcleos que se desintegran en un intervalo de tiempo es directamente proporcional al tiempo y al número de núcleos existentes. Esta ley sirve como método de datación geológica ya que se puede utilizar para conocer la edad de una roca. Las rocas contienen átomos inestables llamados isótopos radiactivos. Estos se desintegran y se transforman en otros. El isótopo radiactivo se denomina elemento padre y el nuevo elemento hijo. La desintegración se realiza a un ritmo constante que puede ser medido.
El carbono-14 es el isótopo utilizado en la datación por radiocarbono, el cual es un método de datación radiométrica. Su núcleo contiene 6 protones y 8 neutrones y el valor para el periodo de semidesintegración de este isótopo es de 5568 años, aunque Cambridge le dio un valor de 5730 años. El carbono-14 está presente en todos los materiales orgánicos, por lo que se emplea en la datación de especímenes orgánicos.
Finalmente, un contador Geiger es un instrumento que permite medir la radiactividad de un objeto o lugar. Es un detector de partículas y de radiaciones ionizantes. El primer dispositivo que recibió este nombre solo detectaba partículas alfa y fue inventado por Rutherford y el físico alemás Hans Geiger. Más adelante, Geiger mejoró el aparato con la ayuda de Walther Müller, de este modo, fue capaz de detectar mayor número de radiaciones ionizantes.
EXPERIMENTO DE RUTHERFORD:
El experimento de Rutherford consistía en lanzar partículas alfa (núcleos de helio) a una lámina de metal. Se esperaba que las partículas alfa atravesaran la lámina sin desviarse. Para observar dónde chocaban estas partículas colocaron, detrás y a los lados de la lámina metálica, una pantalla fosforescente.
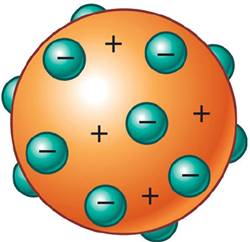
En el modelo atómico de Thomson las cargas positivas y negativas estaban distribuidas uniformemente, por lo que la esfera debía ser eléctricamente neutra, y las partículas alfa pasarían a través de la lámina sin desviarse.
Con los resultados vieron que aunque la mayor parte de las partículas había atravesado la lámina sin desviarse, algunas habían sufrido grandes desviaciones e incluso algunas pocas habían rebotado hacia atrás. Esto significa que las cargas positivas y las negativas no están distribuidas uniformemente y llevó a Rutherford a deducir que hay un núcleo con carga positiva y que los electrones con carga negativa orbitan a su alrededor.
No funcionó con Mica porque es un material muy grueso y las partículas alfa, al ser muy grandes, deterioran a la Mica. Mejoró con pan de oro porque era menos grueso y mejoró mucho con pan de platino porque es un material muy fino y las partículas pueden atravesarlo con mayor facilidad.
Cuando Geiger y Mardsen le contaron a Rutherford que las partículas alfa que había disparado contra la lámina de oro rebotaron, éste dijo: "Es como si se disparara un obús naval de buen calibre sobre una hoja de papel y rebotara". Con esto quiso decir que se trataba de un hecho tan extraño como si una hoja fuese capaz de parar una bala y hacer que rebotara.
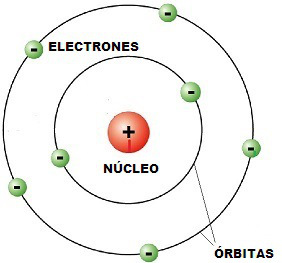
MODELO DE RUTHERFORD:
El modelo atómico de Rutherford fue el primero que consideró que el átomo estaba formado por dos partes: la corteza, constituida por los electrones, con carga negativa, que giran alrededor del núcleo muy pequeño y que concentra toda la carga positiva y la masa del átomo.
Este modelo atómico tuvo una gran importancia, ya que explicaba los resultados que obtuvo Rutherford en sus experimentos. Sin embargo, hubo varias dudas que el modelo no resolvió. Por un lado, se planteó el problema de cómo un conjunto de cargas positivas se mantenían unidas en un volumen tan pequeño. La respuesta llegó unos años más tarde cuando se descubrió la fuerza nuclear fuerte. Por otro lado existía la dificultad proveniente de la electrodinámica clásica, que dice que una partícula cargada y acelerada (los electrones) causaría radiación electromagnética, perdiendo energía y cayendo sobre el núcleo. Se trata de un modelo físicamente inestable.
A Rutherford se le considera el padre de la interacción nuclear ya que gracias a sus aportaciones se pudo llegar a descubrir la fuerza nuclear fuerte, que es una de las 4 interacciones fundamentales y que mantiene el núcleo unido.
Las 4 interacciones fundamentales son las siguientes:
Interacción gravitatoria: La más débil de todas. Su alcance es infinito y hace que cualquier tipo de materia provista de energía interaccione entre sí.
Interacción electromagnética: Actúa entre partículas con carga eléctrica. Es más fuerte que la gravitatoria y también tiene un alcance infinito. Describe casi todas las experiencias de nuestra vida cotidiana
Interacción nuclear fuerte: Se da entre partículas cargadas eléctricamente y es la que mantiene el núcleo del átomo unido. Es la que permite a los quarks unirse para formar hadrones. A pesar de ser la más fuerte, se da en distancias muy cortas (un radio atómico)
Interacción nuclear débil: Su intensidad es menor que la electromagnética y su alcance es menor que el de la nuclear fuerte. Es la responsable de que los quarks y leptones decaigan en partículas más livianas.
NUESTRO ESCUDO:
Este es nuestro escudo. Nuestro lema ‘’Et laborem, et patientiam’’ significa ‘’Con esfuerzo y perseverancia’’ en latín. Con esto queremos decir que se necesita trabajar duro y no rendirse para conseguir grandes cosas. Son cualidades que no solo los científicos deberían tener, sino todas las personas.



.svg.png)